Новий системний підхід до процесу регенерації дерми
- Stats: 1795
- Posted: 17.04.2018
- Author: pmg.company
- Category: Статті
- Comments: 0 Comments
Новий системний підхід до процесу регенерації дерми
Сучасні методи біологічної стимуляції, даючи часом видимі естетичні результати, може бути негативними на функціональному рівні. Метод регенерації тромбоцитарними факторами зростання сьогодні є найбільш фізіологічним в естетичній медицині. Гістологічні дослідження підтверджують, що біостимуляція тромбоцитарними факторами росту стимулює дермальну регенерацію з утворенням колагену ретикулярного (III типу), який зберігається до 9 місяців. Таким чином, ефект цієї біостимуляції позитивний як на функціональному, так і на естетичному рівні.
Регенерація чи репарація
Дуже важливо правильно розділяти процеси регенерації та репарації та розуміти різницю між ними.
Нагадаємо, що під регенерацією ми маємо на увазі фізіологічний процес, що призводить до реконструкції функціонально лабільних тканин. Тобто в результаті регенерації ми отримуємо кількісно та якісно функціональну тканину. У ході регенерації нормалізується кількість тканини, зменшена в процесі природного старіння, стимулюється формування оновленої, багатої на колаген дерми, абсолютно ідентичної втраченої. У результаті маємо кількісну нормалізацію функціональної тканини.
Говорячи про репарацію, ми маємо на увазі патофізіологічний процес, в ході якого замість пошкодженої утворюється нова тканина (фіброзна), багата на колаген I типу, зі зниженою функціональністю. Збільшення колагену I типу характеризує шкіру, що старіє, в той час як збільшення колагену III типу відповідає молодій, функціонально-активній шкірі.
Фактори зростання – трохи історії
Фактори росту є невеликими білковими фрагментами, що належать до групи цитокінів, похідні різних типів клітин і тканин, які здатні активувати та інгібувати функції клітини.
Фактори зростання були відкриті професором Ритою Леві-Монтальчині у співпраці з професором Стенлі Коеном у далекому 1954 році.
Потім, у 1986 році, за важливість відкриття Nerve Growth Factor та його біологічних функцій професорка Рита Леві-Монтальчині була удостоєна Нобелівської премії в галузі медицини. У тому ж 1986 році професор Стенлі Коен отримав Нобелівську премію з фізіології та медицини за відкриття епідермального фактора росту (Epidermal Growth Factor, EGF) та його біологічних функцій.
1971 року вперше почали говорити про наявність біологічно активних факторів у крові. Так, у 1974 році було підтверджено, що біологічно активні фактори, що вивільняються з тромбоцитів, впливають на проліферацію клітин.
В 1999 доктор Едуардо Анітуа (Іспанія) починає використовувати PDGF (фактор зростання тромбоцитів) для поліпшення репаративних процесів. У його роботах завдання факторів зростання тромбоцитів на уражене місце призводило до швидкого загоєння ран.
У 2001 році професор Віктор Гарсія (Іспанія) розпочав наукові роботи з біостимуляції шкіри факторами зростання тромбоцитів, вводячи їх безпосередньо у шкіру, тим самим викликаючи регенерацію тканин.
Фактори росту, після активації, зв’язуються з певними рецепторами – Тирозинкіназою, що призводить до серії внутрішньоклітинних активацій, що ведуть до біологічної реакції. Рецептори тирозинкінази названі так, тому що в їхній внутрішньоклітинній частині, відразу після активації, з’являються і залишаються фосфорильовані залишки тирозину. Фосфорилювання залишків тирозину та викликає реакцію клітинної відповіді. Ця реакція починається з активації рецепторів Фактора росту Білка 2 (Grb2), при якій спостерігається активація Ras, з подальшою передачею сигналу мітоген-активовану протеїнкіназу (MAPК). Це індукує розмноження клітин.
МАПК також активує транскрипційний фактор AP-1, необхідний для читання ДНК. Транскрипційний фактор АР-1, що складається з генів Jun і Fos, дозволяє приєднання РНК-полімераз до ДНК синтезування білка після транскрипції. Це сприяє як зростанню числа клітин, і збільшенню продуктів їх синтезу.
Підсумком цих внутрішньоклітинних механізмів є поділ клітини та посилення метаболізму.
Наукові обґрунтування
Для розробки протоколу з регенерації дерми професор Віктор Гарсія (Іспанія) та професор Мауріціо Чеккареллі (Італія) провели поглиблене вивчення наукової літератури щодо факторів зростання тромбоцитів та біологічних процесів, пов’язаних з ними.
Чинники зростання містяться в тромбоцитах в спеціальних альфа-гранулах. Тромбоцити містять різні типи гранул. Альфа-гранули вивільняють PDGF (тромбоцитарний фактор росту), PF4 (тромбоцитарний фактор 4), фактор V, фактор XIII, фібриноген, тоді як дельта-гранули (щільні тільця) вивільняють серотонін, ADP та кальцій.
У тромбоцитах багато інших факторів росту, що також сприяють біологічній регенерації тканин. (Див. таблицю)
|
Діяльність факторів зростання
|
|||||
|
Проліферація остеобластів |
Проліферація фібробластів |
Хемотаксис |
Синтез дермального матриксу |
Васкуляризація |
|
| PDFG | ++ | ++ | + | ++ | * |
| TGF | +/- | +/- | + | ++ | * |
| EGF | – | ++ | + | * | – |
| IGF | ++ | + | ++ | ++ | – |
| VEGF | * | – | – | – | ++ |
|
++ багаторазово збільшує + зростає – без ефекту * непрямий ефект
|
|||||
Один із них із найвищою концентрацією — IGF-1 (інсуліноподібний фактор росту).
Фактори росту, що вивільняються з тромбоцитів, зокрема PDGF та IGF, особливо підходять для регенерації дерми, беруть участь у синтезі дермального матриксу та активації фібробластів.
У статті, опублікованій у журналі J. Biol Chem у липні 2008 року, йдеться, що концентрація вже 5 нг/мл факторів зростання є достатньою для індукції проліферації фібробластів.
У статті, опублікованій у журналі Blood у серпні 1984 року, повідомляється, що концентрація PDGF у плазмі крові здорової людини після дегрануляції (активації) тромбоцитів становить близько 20 нг/мл.
Кожен окремий тромбоцит при активації та дегрануляції виділяє 7,5 х 10-8 (десять у восьмому ступені) нанограм PDGF. Отже, в цілісній плазмі кількісна присутність факторів росту тромбоцитів у 4 рази перевищує концентрацію, мінімально необхідну для стимулювання біологічних функцій клітини. З цього випливає, що для запуску процесу регенерації шкірної тканини достатньо використання цільної плазми, отриманої після центрифугування.
PDGF вивільняються з тромбоцитів, пов’язаних з гепаринсульфатом (прим. Гепаринсульфат знаходиться в багатьох органах і тканинах, він входить до складу протеогліканів базальних мембран і є постійним компонентом клітинної поверхні), після чого, у вигляді димерів, вони зв’язуються з рецепторами тирозинки .
Та ж стаття, опублікована в журналі Blood у серпні 1984 року, говорить нам про те, що період напіврозпаду PDGF, звільнених від гепаринсульфатів, дуже короткий – близько 2 хвилин. Після цього ми маємо практично нульовий біологічний ефект.
Тому правильна активація тромбоцитів є дуже важливою. Ми не використовуємо в нашому протоколі жодних додаткових активаторів, у вигляді кальцію, наприклад, а вводимо плазму з не активованими тромбоцитами безпосередньо в дерму, де відбувається прямий контакт тромбоцитів з дермальним колагеном, викликаючи їх активацію та дегрануляцію, з вивільненням факторів зростання тромбоцитів .
Крім того, дослідження, опубліковане в 2008 році в «Комунікативній та інтегративній біології», повідомляє, що через 6-8 годин після першої стимуляції PDGF та іншими факторами росту, на клітинній поверхні фібробласта спостерігається збільшений набір рецепторів. Виходячи з цього, через 6-8 годин після першої стимуляції фібробластів, ми пропонуємо провести другу фазу, але цього разу, використовуючи плазму особливо багату тромбоцитами (PRP), на ділянках особи з видимими ознаками старіння.
Професор Віктор Гарсія та доктор Гонсалес Ніколас Албандеа Дж. Антоніо провели гістологічну оцінку дерми після введення PDGF та опублікували в International Journal Of Cosmetic Medicine And Surgery результати цієї роботи. (Мал. 1)
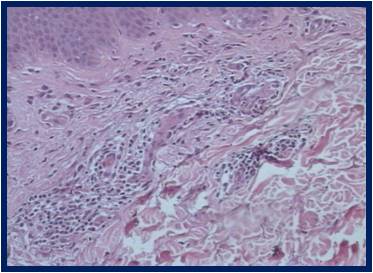
Рис. 1(а). Через 7 днів після біостимуляції з факторами росту PDGF ми маємо максимальний ангіогенез, який є новим виробництвом судин і поліпшенням мікроциркуляції в стимульованій тканині.
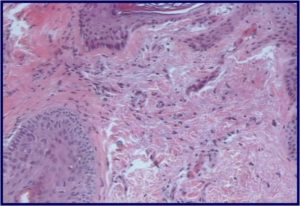
Рис. 1(б). Через 30 днів після дермальної біостимуляції факторами зростання ми маємо високу концентрацію активованих фібробластів (проліферацію).
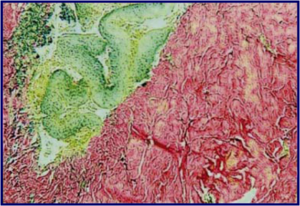
Рис. 1(в). Через два місяці ми маємо освіту «молодого» ретикулярного колагену III типу (реальне омолодження).
Через 7 днів після біостимуляції з PDGF відбувається максимальний ангіогенез, тобто. виникнення нових судин та покращення мікроциркуляції в стимульованих тканинах. Через 30 днів після біостимуляції шкіри факторами росту була зафіксована висока концентрація активованих фібробластів (проліферація). Через два місяці було відзначено утворення нової молодої матриці, багатої на колаген III типу, що відповідає реальному омолодження. Таким чином, був створений протокол регенерації шкіри з використанням PDGF, що має під собою серйозну наукову основу.
На сьогоднішній день дослідження Віктора Гарсії та Мауріціо Чеккареллі просунулися далеко вперед. Створено остаточний протокол щодо регенерації всіх тканин особи, що має назву «Повна медична регенерація». Остаточний протокол був опублікований у 2010 році у The Physiological Medical Letter.
Протокол Full Face Medical Regenera®tion дозволяє регенерувати:
епідерміс;
дерму;
гіподерму;
кістку.
Для цього також використовується термін “медичний фейсліфтінг”. У цьому протоколі ми використовуємо отримані від пацієнта аутологічні продукти, зокрема:
аутологічну цільну плазму з тромбоцитами;
PRP – аутологічну плазму, багату на тромбоцити;
аутологічний плазмовий фібрин;
аутологічні стовбурові клітини жиру;
аутологічну підтримуючу біотканину + трикальційфосфат.
Актуальні розробки. Старі та молоді фібробласти
Ґрунтуючись на клінічних результатах, отриманих протягом п’ятнадцятирічного досвіду застосування регенеративного лікування шкіри, професор Мауріціо Чеккареллі поглибився у вивчення причин різних результатів, отриманих у ході лікування у молодих та літніх пацієнтів, та розпочав пошук вирішення проблем, пов’язаних із лікуванням шкіри людей похилого віку.
Старіючі фібробласти мають дві негативні характеристики: скорочене число рецепторів, зі зниженою відповіддю на стимуляцію, та відсутність потужностей для виробництва ретикулярного колагену та протеогліканів, на противагу фіброзному колагену.
Крім того, старі фібробласти вже використовували більше мітозів, і стимуляція проліферативної активності з PDGF сприяє якнайшвидшому досягненню межі Хейфліка і, відповідно, клітинної загибелі.
Вирішення цієї проблеми — знайти спосіб утворення нових молодих фібробластів у шкірі. Фібробласти, як і всі мезодермальні клітини, вимагають диференціації від стовбурових клітин при впровадженні для відновлення тканини. Тому спочатку необхідне внутрішньошкірне введення мезенхімальних стовбурових клітин і лише потім застосування факторів росту тромбоцитів.
Для цього ми можемо виділити судинно-стромальну частину жирової тканини, оскільки імуногістохімічні та імунофлуоресцентні аналізи показали, що стовбурові клітини розташовані безпосередньо в периваскулярній сполучній тканині разом із перицитами. Після вилучення жирової тканини спочатку фрагментуємо отриманий матеріал механічно, для отримання дрібних частинок, легко пов’язаних з колагеназою. Потім працюємо з фрагментами жирової тканини з колагеназою для вивільнення стовбурових клітин. Після того, як розчинена сполука, проводимо безліч очищення для усунення слідів колагенази та отримання стовбурових клітин, придатних для ін’єкцій.
Однак вилучення жирової тканини вимагає хірургічної клініки, а процес виділення та очищення стовбурових клітин – стерильності та захищеності. Цей метод обмежує можливість проведення процедури регенерації шкіри в амбулаторних умовах.
Ми поглибили наші дослідження для вирішення цієї проблеми. Наукова література містить відомості про те, що у всіх тканинах організму присутні стовбурові клітини. Саме вони працюють над регенерацією тканини, що зазнала невеликих ушкоджень. Навпаки, великі ушкодження зазнають процесів репарації (рубець), із втратою обсягу клітин, апоптозом чи некрозом.
Існує також пул постійно циркулюючих у крові стовбурових клітин. При незначних пошкодженнях ці клітини, шляхом діапедезу, переміщаються в тканини, і починається процес регенерації. Нагадаємо, що стимул для диференціювання мезенхімальних клітин дає запалення. Зокрема, вивільняються фактори зростання. Стовбурові клітини у латентній фазі завжди присутні у шкірі. Тому ми не вважаємо за необхідне введення нових стовбурових клітин у шкіру з метою утворення молодих фібробластів. Ми просто стимулюємо диференціювання вже присутніх у стані спокою (сплячих) стовбурових клітин.
Наукова література говорить також, що стимулом для диференціювання стовбурових клітин у стані спокою є виділення невеликої кількості ROS (вільних радикалів кисню). ROS є внутрішньоклітинними посередниками, що регулюють функції клітини. У невеликих кількостях ROS стимулюють диференціювання стовбурових клітин у стані спокою, тоді як у великих кількостях викликають апоптоз. У наших тканинах стовбурові клітини, які перебувають у стані спокою, піддавшись стимуляції внаслідок легкого пошкодження (ROS), активуються, диференціюються та регенерують тканини.
Отже, низькі концентрації ROS (0,1-0,5 мМоль/л) стимулюють диференціацію стовбурових клітин, що перебувають у спокої, тоді як вищі концентрації (понад 1,0 мМоль/л) стимулюють клітинний апоптоз. Виходячи з цього, ROS у концентрації більшій, ніж 1,0 мМ/л, індукують загибель клітин шляхом апоптозу, тоді як нижчі концентрації – від 0,1 до 0,5 мМ/л – стимулюють диференціацію сплячих стовбурових клітин. Тому ми шукали можливість, яка б дозволила нам провести правильний стехіометричний розрахунок виділених ROS .
Аскорбінова кислота у присутності іонів тривалентного заліза активує реакцію Фентона з викидом ROS. На основі описаної хімічної реакції, можна розрахувати стехіометричним чином кількість ROS, що вивільняються, залежно від заданої кількості аскорбінової кислоти. Для апоптозу використовуємо концентрацію 5 мМ/л аскорбінової кислоти в розчині тривалентного заліза.
Концентрація ROS 0,34 мМ/л є достатньою для запуску диференціації сплячих стовбурових клітин. Внутрішньошкірні ін’єкції даного розчину дозволяють активувати диференціювання стовбурових клітин як у дермі, так і безпосередньо в епідермісі. Процес диференціації клітин завершується протягом 21 дня з моменту ін’єкційного введення розчину і дозволяє отримати нові молоді фібробласти, здатні будувати ювенільну матрицю.
Через 21 день після активації стовбурових клітин ми активуємо проліферацію та метаболічну активність новостворених фібробластів шляхом введення в дерму факторів росту тромбоцитів (аутоплазмотерапія, PRP-терапія). Все це дозволяє реально омолодити шкіру. ROS індукують процес диференціювання сплячих стовбурових клітин у нові фібробласти, PDGF (фактори зростання тромбоцитів) активують проліферацію та метаболічну активність останніх та регенерацію шкіри з утворенням нового ретикулярного колагену.
У результаті цей процес регенерації шкіри передбачає активацію диференціювання сплячих стовбурових клітин із подальшою стимуляцією їх проліферації та метаболізму.
Виділення факторів зростання тромбоцитів
Тепер давайте розглянемо правильну техніку виділення та використання факторів зростання тромбоцитів.
По-перше, ми повинні правильно вибрати пробірки для отримання плазми збагаченої тромбоцитами. Пробірки можуть містити роздільний гель, здатний відокремити еритроцити та поліморфні елементи від плазми з тромбоцитами (лімфоцитами). Пробірки повинні також містити антикоагулянт, зокрема цитрат натрію 3,8%. Ця сіль, у присутності кальцію, утворює ще стійкішу сіль — цитрат кальцію. Секвестрація кальцію призводить до неможливості переходу протромбіну в тромбін, таким чином запобігаючи згортанню крові.
На ринку є комерційні пробірки, що містять гепарин як антикоагулянт. Але гепарин пов’язується з фактором крові антитромбіну III, активуючи його. АТ-III, активний, інактивує тромбін, запобігаючи згортанню крові. Такі пробірки не повинні використовуватися, оскільки гепарин ушкоджує тромбоцити. Наукова література має підтвердження, що гепарин спричиняє агрегацію тромбоцитів, внаслідок чого відбувається передчасна дегрануляція та втрата факторів зростання PDGF. Крім того, літературні посилання вказують на те, що гепарин зменшує кількість активних тромбоцитів, що містять PDGF та їх біологічні функції.
Після центрифугування крові, у пробірці ми отримуємо поділ на дві фракції: червоні кров’яні клітини та поліморфно-ядерні (перебувають під гелем) та плазму з мононуклеарними клітинами та тромбоцитами (над гелем). Шляхом обережного перевертання пробірки розподіляємо тромбоцити в плазмі, роздільний гель при цьому не дозволяє двом фракціям змішатись. Робимо отвір голкою в гумовій пробці та шприцом витягаємо всю отриману цільну плазму (Plasma Integer).
Для отримання PRP ми обережно дістаємо пробірку з центрифуги, робимо отвір голкою в гумовій пробці і витягаємо шприцом, не перевертаючи пробірку, верхні 2/3 плазми. Потім обережно обертаємо пробірку з плазмою, що залишилася, і шприцом витягаємо решту плазми — PRP.
У процесі поділу крові в пробірці зі спеціальним гелем ми отримуємо плазму, де тромбоцити змішані з мононуклеарними лейкоцитами. Відповімо на запитання: «Чи може присутність білих кров’яних клітин у плазмі мати негативну дію?»
Тромбоцити у шкірі активуються, приєднуючись до колагену за допомогою фактора Віллебранта. Цей процес супроводжується дегрануляцією із вивільненням факторів зростання. Поліморфонуклеари, для активації та вивільнення активної речовини, повинні перебувати в запальному середовищі, тоді як лімфоцити звільняють цитокіни запалення лише у присутності гетерологічних антигенів. Звідси випливає, що можлива присутність лейкоцитів у нашому процесі не має жодних позитивних чи негативних результатів.
Використання аутологічного плазмового фібрину
Метою внутрішньошкірної інфільтрації APF (аутологного плазмового фібрину) є створення в потрібному місці тривимірної основи, куди мігрують фібробласти, і отримання в цій області переважної регенерації тканин.
Щоб наша конструкція з фібрину функціонувала довше, ми повинні уповільнити розсмоктування згустку, яке слідує за перетворенням плазміногену на плазмін. Швидке центрифугування при високій кількості обертів для видалення тромбоцитів і запобігання вивільненню тромбостеніну відповідає за ретракцію тромбу. Після центрифугування робимо забір плазми у фазі коагуляції. До введення ми можемо додати транексамову кислоту (амінокапронова кислота), щоб запобігти перетворенню плазміногену на плазмін (однієї краплі достатньо на 10 мл).
Давайте подивимося, що нам необхідно для отримання аутологічного плазмового фібрину (APF). Ми повинні взяти зразок венозної крові в пробірку, що не містить ні антикоагулянт, ні активатор коагуляції, і провести швидке (2 хв) центрифугування на високих оборотах. Для роботи нам необхідно близько 10-12 хвилин – фізіологічний час коагуляції плазми (з моменту забору крові у пробірку та до ін’єкційного внутрішньодермального введення).
Протокол процесу регенерації дерми
Давайте подивимося весь процес регенерації дерми практично.
Етап 1-й – стимуляція вироблення молодих фібробластів.
На початковому етапі нашого протоколу ми стимулюємо утворення нових молодих фібробластів, використовуючи препарат із розчином аскорбінової кислоти у присутності тривалентного заліза, вивільняючи у шкірі 0,34 ммоль ROS. Таким чином, протягом 21 дня стимулюємо диференціювання стовбурових клітин, присутніх у шкірі. У місцях стимулювання отримуємо нові молоді фібробласти, які здатні будувати ювенільну матрицю.
Етап 2-й – регенерація тромбоцитарних факторів зростання.
Через 21 день після стимуляції вироблення молодих фібробластів пацієнт повертається до нас для проведення другої фази регенерації – тромбоцитарними факторами росту. Проводимо у необхідній кількості забір крові пацієнта для введення у всі обрані нами області. Готуємо збагачену тромбоцитами плазму (Plasma Integer). Вводимо внутрішньодермально для стимулювання проліферативних та метаболічних функцій молодих новостворених фібробластів. Ми використовуємо всю отриману плазму, оскільки кількість PDGF в одному її мілілітрі вчетверо вище, ніж це необхідно для стимулювання клітин, що містяться в тому ж обсязі (про це ми говорили вище).
Ми використовуємо пробірки з гелем, здатним відокремлювати еритроцити та поліморфні клітини від плазми з тромбоцитами, з цитратом натрію як антикоагулянт. Центрифугуємо отриману кров (в середньому, при 2500 оборотах на хвилину протягом 5 хвилин), на виході отримуємо поділ: еритроцити та нейтрофільні клітини крові, поміщені під гель, та мононуклеарні клітини та тромбоцити, вміщені над гелем. Обережно перевертаючи пробірку кілька разів, розподіляємо тромбоцити у плазмі, забираємо всю збагачену плазму. Виконуємо шкірну біостимуляцію обраних областей (обличчя, шия, декольте або кисті рук), вводячи плазму в дерму голкою 30G/4 мм. Контакт тромбоцитів з дермальним колагеном призводить до їх активації та подальшої дегрануляції.
Чинники зростання вивільняється з тромбоцитів. Виділяючись, PDGF зв’язується з рецепторами тирозинкінази клітинної активації. Все це забезпечує повноцінний біологічний ефект від PDGF, незважаючи на їх короткий цикл життя.
Ми можемо контролювати процес дегрануляції тромбоцитів у дермі та виділення PDGF, оскільки одночасно відбувається дегрануляція щільних тіл або дельта-гранул. Дегрануляція останніх вивільняє серотонін, який на рівні шкіри провокує появу на ній легкого почервоніння, легкої сверблячки, місцевої температури, тим самим вказуючи пацієнту і лікарю на вивільнення факторів росту.
Для поліпшення біологічної реакції, можна повторити біостимуляцію через 6-8 годин. Повторна біостимуляція проводиться після закінчення даного часу, тому що через 6-8 годин ми маємо збільшене число рецепторів на поверхні фібробластів, отже, повторна біостимуляція з PDGF індукує кращу біологічну відповідь. На цей раз ми використовуємо фактори зростання тромбоцитів у більшій концентрації, а саме PRP. Здійснюємо відокремлення плазми шляхом центрифугування, видаляємо верхні 2/3 плазми. Потім гомогенізуємо тромбоцити шляхом обережного перевертання пробірки і отримуємо їх концентрацію приблизно втричі вище за вихідну. Ця біостимуляція проводиться на особливо пошкоджених ділянках особи, де потрібний найбільший відгук. Вводимо тромбоцити внутрішньошкірно для зв’язку з колагеном і отримання дегрануляції.
Така регенерація шкіри індукує проліферацію фібробластів (збільшення їх числа) та подальше формування нової матриці, багатої колагеном III (ювенільного) типу, тобто омолодження. Проліферація відбувається протягом 30 днів з перших ін’єкцій факторів росту з великою кількістю активованих фібробластів.
Етап 3-й – аутологічний плазміний фібрин/амінокислоти.
Корисним буде спрямувати дію отриманих фібробластів у місця найбільшої потреби та оптимізувати їхню роботу. Аутологічний плазмовий фібрин (APF) коагулює та утворює в місці введення решітку-основу для міграції фібробластів, з подальшою регенерацією тканини безпосередньо в цьому місці. Такими місцями зазвичай є поверхневі зморшки, місця мінус-тканини (депресії) та кисті рук. Інфільтруємо аутологічний фібрин в дерму, у певних місцях для цільової роботи там фібробластів.
Гістологічні дослідження показали, що через 30 днів після першої біостимуляції дерми аутоплазмою у зоні введення спостерігається максимальна проліферація фібробластів. Тому біостимуляція амінокислотами (попередниками матричних компонентів дерми) доцільно проводити через 30 днів після першої процедури з аутоплазмою. Введення амінокислот у присутності бікарбонатного буфера дозволяє сформувати, відповідно до принципів ендомодуляції, ідеальну концентрацію компонентів матриці. Коригування рН-середовища, близьке до фізіологічного значення 7.4, допомагає формуванню ретикулярного колагену. Навпаки, серед кислої, багатої позитивними зарядами, має місце виділення карбоксильних фрагментів (негативно заряджених) і утворення колагену I типу. Шляхом папульного введення проводимо цю дермальну стимуляцію по всій поверхні обличчя, шиї, декольте або кистей рук.
Цей повний цикл регенерації шкіри може повторюватися кілька разів на рік.
Бібліографія
1. Abhishek Sohni and Catherine M. Verfaillie Mesenchymal Stem Cells Migration Homing and Tracking Stem Cells International Volume, 2013 (2013), Article ID 130763, 8 pages.
Ae-Ri Ji,1,2,* Seung-Yup Ku,1,2,* Myung Soo Cho, 3 Yoon Young Kim, 2 Yong Jin Kim,1 Sun Kyung Oh, 2 Seok Hyun Kim,1, 2 Shin Yong Moon ,1, 2 і молодий Min Choicorresponding author 1, 2 Reactive oxygen species сприяння диференціації людських ембріонних стім клітин в mesendodermal lineage, Exp Mol Med. 2010 Mar 31; 42 (3): 175-186.
Anitua E. Використання plasma-rich зростаючих factors (PRGF) в oral surgery. Pract Proced Aesthet Dent. 2001 Aug;13(6):487-93; quiz 487-93.
Barbara Gunnella, Maurizio Ceccarelli. Attivazione cellule staminali quiescenti Physiologica Medical Letter Vol.XI September 2016, N°2
Borregaard N1, Cowland JB. Грунти людського neutrophilic polymorphonuclear leukocyte. Blood. 1997 May 15; 89 (10): 3503-21.
Bowen-Pope DF, Malpass TW, Foster DM, Ross R. Platelet-знімається зростаючим factor in vivo: рівні, діяльність, і обмеження. Blood. 1984 Aug; 64 (2): 458-69.
Carr A1, Frei B. Does vitamin C act as a pro-oxidant under physiological conditions? FASEB J. 1999 р. Jun;13(9):1007-24.
Cell Transplant. 2012; 21(2-3):601-7
De Donatis A, Cirri P. Підтверджує специфічність receptoru тиросіну кінаси signaling. Commun Integr Biol. 2008; 1(2):156-7.
De Donatis A, Comito G, Buricchi F, Vinci MC, Parenti A, Caselli A, Camici G, Manao G, Ramponi G, Cirri P. Proliferation versus migration в platelet-derived зростаючий factor signaling: key role of endocytosis. J Biol Chem. 2008 Jul 18; 283 (29): 19948-56.
Dhurat R1, Sukesh M1. Principles and Methods of Preparation of Platelet-Rich Plasma: A Review and Author’s Perspective. J Cutan Aesthet Surg. 2014 Oct-Dec; 7 (4): 189-97. doi: 10.4103/0974-2077.150734.
Dieter Paul, Allan Lipton, і Ingrid Klinger, Serum Factor Requirements of Normal and Simian Virus 40-Transformed 3T3 Mouse Fibroblasts Proc Natl Acad Sci, US A. 1971 Mar; 68(3): 645-648.
Eika C. Platelet Aggregating Effect of Eight Commercial Heparins, Scandinavian Journal of Haematology, Volume 9, Issue 1-6, pages 480–482, March 1972
Elisa Carrasco, Maria I. Calvo, Alfonso Blázquez-Castro, Daniela Vecchio, Alicia Zamarrón, Irma Joyce Dias de Almeida, Juan C. Stockert, Michael R. Hamblin, Angeles Juarranz, і Jesús Espada1, Photoactivation ROS production in situ transiently activates смужка проліферації в шкірі і в шкірі follicle stem смужка ніші, що спричиняє зростаючий і занурення, J Invest Dermatol. 2015 Nov; 135(11): 2611-2622.
García Гіменеза J. Víctor – González Nicolás Alban J. Antonio, Tratamiento del envejecimiento cutaneo mediante bioestimulación con factores de crecimiento autógenos. International Journal Of Cosmetic Medicine and Surgery Volume 7 – 2 – 2005.
Jai Pal Singh, Margery A. Chaikin та Charles D. Stiles. Phylogenetic Analysis of Platelet-Derived Growth Factor by Radio-Receptor Assay. The Journal of Cell Biology, Vol. 95, No. 2, Part 1 (Nov., 1982), pp. 667-671
John Tower Stress and stem cells Wiley Interdiscip, Rev Dev Biol. 2012 Nov-Dec; 1(6): 10.1002/
Kawazoe T, Kim HH. Tissue augmentation by white blood cell-containing platelet-rich plasma.
Malmström J, Westergren-Thorsson G. Heparan sulfate upregulates platelet-derived зростаючих факторів receptors on human lung fibroblasts. Глікобіологія. 1998 Dec; 8 (12): 1149-55.
Maurizio Ceccarelli, J. Victor García. Full Face Regenera®tion: theoretical and practical protocol.
Maurizio Ceccarelli. Trattamento delle adiposità localizzate для apoptosi degli adipociti. The Physiologica Medical Letter Vol.V Dicember, 2011 N°4
Mishra PJ, Banerjee D. Activation and differentiation of mesenchymal stem cells. Methods Mol Biol. 2011; 717: 245-53.
Patrick C. Baer and Helmut Geiger Adipose-Derived Mesenchymal Stromal/Stem Cells: Тиху Localization, Characterization, and Heterogeneity Stem Cells Int. 2012; 2012: 812693.
R. Levi-Montalcini. The nerve growth factor: тридцять років later. EMBO J. 1987 May; 6(5): 1145-1154.
Roberts DE, McNicol A, Bose R. Mechanism of collagen activation in human platelets. J Biol Chem. 2004 May 7; 279 (19): 19421-30.
Rong YH, Zhang GA, Wang C, Ning FG. Quantification of type I and III collagen content in normal human skin in different age groups. Zhonghua Shao Shang Za Zhi. 2008 Feb;24(1):51-3.
Russell Ross, John Glomset, Beverly Kariya, і Laurence Harker A. Platelet-Dependent Serum Factor, що стимулює очищення артеріальних добрих м’язів зубів у Vitro, Proc Natl Acad Sci US A. 1974 Apr; 71 (4): 1207-1210.
Stanley Cohen. Origins of Growth Factors: NGF і EGF. J Biol Chem. 2008 р. Dec 5; 283 (49): 33793-33797.
Stanley Cohen, Rita Levi-Montalcini, і Віктор Hamburger. A nerve growth-stimulating factor isolated from sarcom as 37 and 180* Proc Natl Acad Sci, US A. 1954 Oct; 40(10): 1014-1018.
Sudhir Gupta, William E. Paul, Ralph Steinman. Mechanisms of Lymphocyte Activation and Immune Regulation X: Innate Immunity Springer US, 28 apr 2005 – 163 pagine
The Physiologica Medical Letter, Vol.2 May 2010 N°1
Tullia Maraldi, Cristina Angeloni, Elisa Giannoni і Christian Sell, Reactive Oxygen Species в Stem Cells Oxid Med Cell Longev. 2015; 2015: 159080.
Valerie Horsley, Antonios O. Aliprantis, Lisa Polak, Laurie H. Glimcher і Elaine Fuchs NFATc1 баланси quiescence і proliferation skin stem cells Cell. 2008 Jan 25; 132(2): 299-310.